proyecto química 11
sábado, 1 de septiembre de 2018
semana 28
Durante esta semana se realiza la decoración para la celebración del día de la antioqueñidad
Semana 27
Mecanismos de sustitución no polar
Mecanismo de la reacción
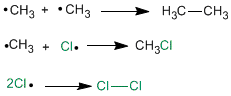
Las halogenaciones radicalarias trancurren en tres etapas denominadas: iniciación, propagación y terminación:
Etapa de iniciación
En el primer paso de la reacción se produce la rotura homolítica del enlace Cl-Cl. Esto se consigue con calor o mediante la absorción de luz.
Primera etapa de propagación
Se trata de una etapa ligeramente endotérmica que consiste en la sustracción de un hidrógeno del metano por el radical cloro formado en la etapa anterior, generándose el radical metilo.
Segunda etapa de propagación
Durante la misma el radical metilo abstrae un átomo de cloro de una de las moléculas iniciales, dando clorometano y un nuevo átomo de cloro. Dicho átomo vuelve a la primera etapa de propagación y se repite todo el proceso.
Etapa de terminación
Tiene lugar cuando se agotan los reactivos, entonces los radicales que hay en el medio se unen entre si.
semana 26
Reacción químicas orgánicas
Las reacciones orgánicas son reacciones químicas que involucran al menos un compuesto orgánico como reactivo. Los tipos básicos de reacciones químicas orgánicas son reacciones de adición, reacciones de eliminación, reacciones de sustitución, y reacciones redox orgánicas.
En síntesis orgánica, se usan reacciones orgánicas en la construcción de nuevas moléculas orgánicas. La producción de muchos químicos hechos por el hombre, tales como drogas, plásticos, aditivos alimentarios, textiles, dependen de las reacciones orgánicas.
Reactivos orgánicos
Electrofilo
Un electrófilo es un reactivo químico atraído hacia zonas ricas en electrones que participa en una reacción química aceptando un par de electrones formando un enlace con un nucleófilo. Ya que los electrófilos aceptan electrones, ellos son ácidos de Lewis (ver teorías de reacciones ácido-base). La mayoría de los electrófilos están cargados positivamente, tienen un átomo que lleva una carga positiva parcial o bien no posee un octeto de electrones.
Nucleofilo
En química un nucleófilo es una especie que reacciona cediendo un par de electrones libres a otra especie (el electrófilo), combinándose y enlazándose covalentemente con ella. Un nucleófilo, concepto cinético, es también por definición una base de Lewis, concepto termodinámico. Un nucleófilo puede ser un anión o una molécula neutra con un par de electrones libres.
Las reacciones orgánicas son reacciones químicas que involucran al menos un compuesto orgánico como reactivo. Los tipos básicos de reacciones químicas orgánicas son reacciones de adición, reacciones de eliminación, reacciones de sustitución, y reacciones redox orgánicas.
En síntesis orgánica, se usan reacciones orgánicas en la construcción de nuevas moléculas orgánicas. La producción de muchos químicos hechos por el hombre, tales como drogas, plásticos, aditivos alimentarios, textiles, dependen de las reacciones orgánicas.
Reactivos orgánicos
Electrofilo
Un electrófilo es un reactivo químico atraído hacia zonas ricas en electrones que participa en una reacción química aceptando un par de electrones formando un enlace con un nucleófilo. Ya que los electrófilos aceptan electrones, ellos son ácidos de Lewis (ver teorías de reacciones ácido-base). La mayoría de los electrófilos están cargados positivamente, tienen un átomo que lleva una carga positiva parcial o bien no posee un octeto de electrones.
Nucleofilo
En química un nucleófilo es una especie que reacciona cediendo un par de electrones libres a otra especie (el electrófilo), combinándose y enlazándose covalentemente con ella. Un nucleófilo, concepto cinético, es también por definición una base de Lewis, concepto termodinámico. Un nucleófilo puede ser un anión o una molécula neutra con un par de electrones libres.
semana 25
Laboratorio ácidos carboxilicos
Clasificación de los azucares:

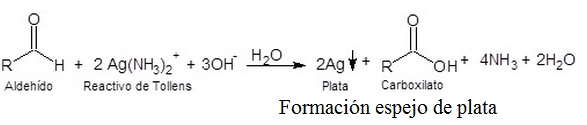
El reactivo de Tollens
El reactivo de Tollens es un complejo acuoso de diamina-plata, presentado usualmente bajo la forma de nitrato. Recibe ese nombre en reconocimiento al químico alemán Bernhard Tollens. Se usa en ensayos cualitativos de aldehidos, cetonas y enoles.
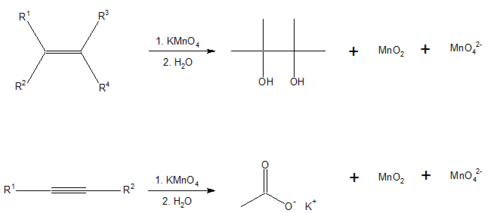
El reactivo de Baeyer
El reactivo de Baeyer es una solución alcalina de permanganato de potasio en solución básica, que es un potente oxidante. La reacción con los enlaces dobles (-C=C-) o triples (-C≡C-) en un material orgánico ocasiona que el color se desvanezca de púrpura-rosado a marrón. Los aldehídos y el ácido fórmico (y los ésteres de ácido fórmico) también dan una prueba positiva.
El reactivo de Biuret

El reactivo de Lucas
Clasificación de los azucares:

El reactivo de Tollens
El reactivo de Tollens es un complejo acuoso de diamina-plata, presentado usualmente bajo la forma de nitrato. Recibe ese nombre en reconocimiento al químico alemán Bernhard Tollens. Se usa en ensayos cualitativos de aldehidos, cetonas y enoles.
El reactivo de Baeyer
El reactivo de Baeyer es una solución alcalina de permanganato de potasio en solución básica, que es un potente oxidante. La reacción con los enlaces dobles (-C=C-) o triples (-C≡C-) en un material orgánico ocasiona que el color se desvanezca de púrpura-rosado a marrón. Los aldehídos y el ácido fórmico (y los ésteres de ácido fórmico) también dan una prueba positiva.

El reactivo de Biuret
Está hecho de hidróxido potásico (KOH) y sulfato cúprico (CuSO4), junto con tartrato de sodio y potasio (KNaC4O6·4H2O). El reactivo, cambia a violeta en presencia de proteínas, y vira a rosa cuando se combina con polipéptidos de cadena corta. El hidróxido de potasio no participa en la reacción, pero proporciona el medio alcalino necesario para que tenga lugar.
Se usa normalmente en el ensayo de Biuret, un método colorimétrico que permite determinar la concentración de proteínas de una muestra mediante espectroscopía ultravioleta-visible a una longitud de onda de 540 nm (para detectar el ion Cu2+).

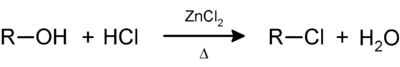
El reactivo de Lucas
El reactivo de Lucas es una solución de ZnCl2 disuelto en HCl concentrado que se usa en química orgánica. Esta disolución es usada para clasificar alcoholes de bajo peso molecular. La reacción es una sustitución en el cual el cloruro reemplaza el grupo hidroxilo. Un ensayo positivo es indicado por un cambio desde una solución limpia y sin color a una turbidez, que se trata de la formación de un cloroalcano.
semana 24
ISOMERÍA ÓPTICA
Existen moléculas que coinciden en todas sus propiedades excepto en su capacidad de desviar el plano de luz polarizada. Son los llamados isómeros ópticos. Uno de ellos desvía la luz hacia la derecha, y se designa (+), o dextrógiro, mientas que el otro la desvía en igual magnitud pero hacia la izquierda, y se designa (-) o levógiro. El aparato que aparece en la foto de la derecha es un polarímetro.
Para entender cómo funciona observa las animaciones de la Tabla inferior

Su comportamiento frente a la luz polarizada se debe a que la molécula carece de plano de simetría, y por lo tanto se pueden distinguir dos isómeros que son cada uno la imagen especular del otro, como la mano derecha lo es de la izquierda. Ambas manos no son iguales (el guante de una no encaja en la otra), pero son simétricas: la imagen especular de la mano derecha es la mano izquierda. Los isómeros ópticos también se llaman enantiómeros, enantiomorfos o isómeros quirales. El caso más frecuente de ausencia de plano de simetría se debe a que algún carbono tetraédrico está unido a cuatro radicales distintos (Figura de la derecha). Este carbono recibe el nombre de carbono asimétrico.
Existen moléculas que coinciden en todas sus propiedades excepto en su capacidad de desviar el plano de luz polarizada. Son los llamados isómeros ópticos. Uno de ellos desvía la luz hacia la derecha, y se designa (+), o dextrógiro, mientas que el otro la desvía en igual magnitud pero hacia la izquierda, y se designa (-) o levógiro. El aparato que aparece en la foto de la derecha es un polarímetro.
Para entender cómo funciona observa las animaciones de la Tabla inferior

Su comportamiento frente a la luz polarizada se debe a que la molécula carece de plano de simetría, y por lo tanto se pueden distinguir dos isómeros que son cada uno la imagen especular del otro, como la mano derecha lo es de la izquierda. Ambas manos no son iguales (el guante de una no encaja en la otra), pero son simétricas: la imagen especular de la mano derecha es la mano izquierda. Los isómeros ópticos también se llaman enantiómeros, enantiomorfos o isómeros quirales. El caso más frecuente de ausencia de plano de simetría se debe a que algún carbono tetraédrico está unido a cuatro radicales distintos (Figura de la derecha). Este carbono recibe el nombre de carbono asimétrico.
semana 23
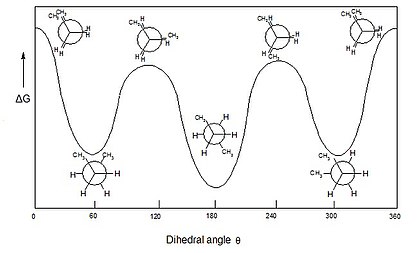
Isomería conformacional
En química orgánica, los isómeros conformacionales o confórmeros son estereoisómeros que se caracterizan por poder interconvertirse (modificar su orientación espacial, convirtiéndose en otro isómero de la misma molécula) a temperatura ambiente, por rotación en torno a enlaces simples. Estas conformaciones se denominan: anti, eclipsada o alternada. Son compuestos que, generalmente, no pueden aislarse físicamente, debido a su facilidad de interconversión.
El análisis conformacional es la exploración de todos los confórmeros que se pueden obtener de una molécula dada al realizar torsiones alrededor de enlaces sencillos (grados de libertad conformacionales), observando los cambios en la energía molecular asociados a esas torsiones.
Suscribirse a:
Entradas (Atom)